近年来,乳腺癌已成为全球女性健康的主要威胁之一,传统化疗虽有效,但其严重的副作用仍限制了疗效的提升。光响应性药物传递系统(DDS)作为一种新兴的治疗方法,因其能够精确控制药物释放的空间和时间,逐渐成为乳腺癌治疗领域的研究热点。然而,要实现精准靶向、定时释放仍面临巨大的挑战。为了解决这一问题,研究人员正在探索创新的药物传递系统,以期更高效地治疗乳腺癌。中南大学湘雅药学院药剂学系陈传品教授团队、中南大学湘雅二医院向大雄团队吴军勇副研究员、以及湖南省药品检验检测研究院王蓉蓉教授团队,针对这一挑战,提出了一系列用于精确药物递送治疗乳腺癌的光控纳米药物。
首先通过π-π堆积将光响应光热治疗(PTT)与光热响应喜树碱(CPT)化疗结合起来。共轭聚合物纳米粒子(cRGD-PTer N25/CPT NPs)是为时空靶向PTT/化疗,能够在近红外光照射下迅速释放化疗药物—CPT,同时结合光热疗法增强局部肿瘤治疗效果。研究表明,cRGD-PTer N25/CPT NPs在近红外光照射下表现出优异的光热转换能力(高达57.4%),能够有效触发药物释放,且释放过程具有空间和时间的双重控制。系统展示了良好的生物相容性,能够在乳腺癌细胞和小鼠模型中显著增强肿瘤细胞的积累,延长血液循环时间,并减少化疗带来的全身毒性。
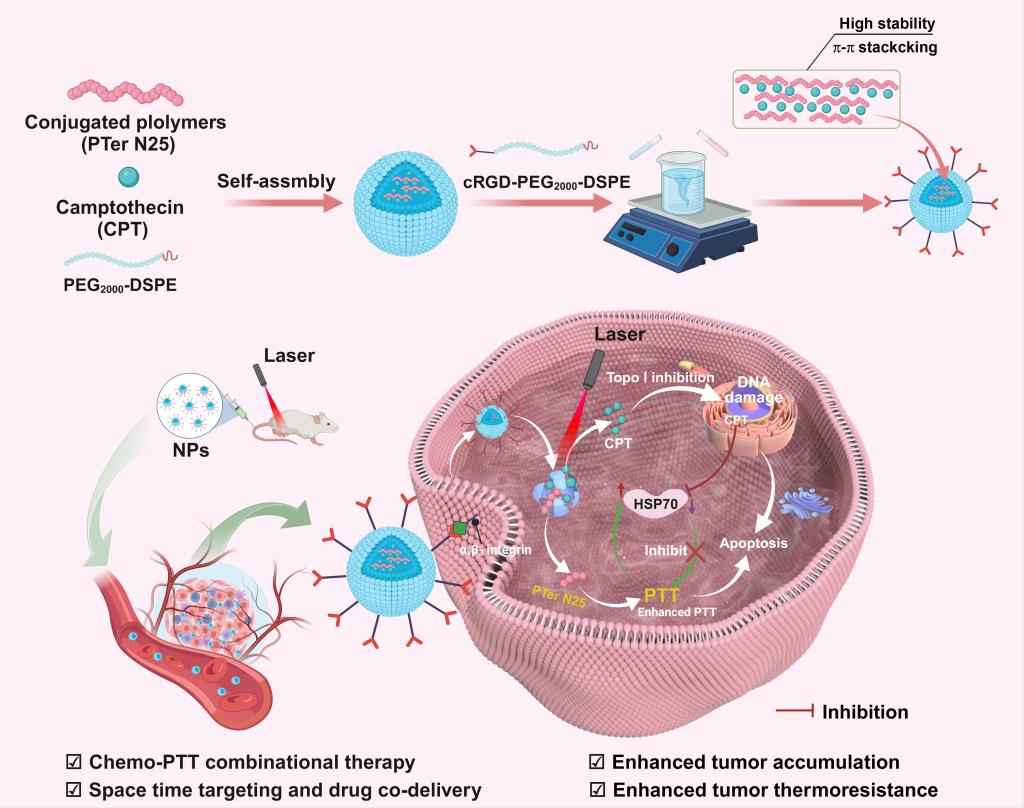
图1.光响应cRGD-PTer N25/CPT NPs的制备及其抗肿瘤机制示意图
基于上述研究基础,研究团队进一步开发了一种新型的“HAIR/CTF纳米炸弹”,研究发现肿瘤细胞和正常细胞在内体/溶酶体中具有相似的酸性pH值或较高的细胞内GSH浓度,因此广泛报道的pH和GSH响应性递药系统表现出有限的选择性。相反,缺氧会显著增加肿瘤组织中的ROS,导致癌细胞中的ROS水平(10-100μM)比正常组织(0.001-0.7μM)高1000倍以上,从而实现选择性药物释放反应。但由于肿瘤的异质性,单纯依靠肿瘤深部内源性ROS来促进药物释放和激活可能无法达到理想的治疗效果。通过最近研究发现IR780是一种经典的光敏剂,IR780在肿瘤中积累,在光照射下可同时发挥癌症光动力疗法(PDT)和光热疗法(PTT)作用,释放ROS杀伤肿瘤细胞。因此研究团队通过HA修饰的IR780(HAIR)和可光裂的前药CTF混合即可自装制备光响应纳米颗粒。纳米颗粒对CD44的肿瘤部位具有高亲和力,因此可以被乳腺癌细胞有效摄取。在光照射下,前药被裂解,纳米颗粒解离,释放出游离的化疗药物CPT和5-氟尿嘧啶。该纳米药物能够实现靶向、时空可控的药物释放,以克服传统药物的溶解度和毒性问题。
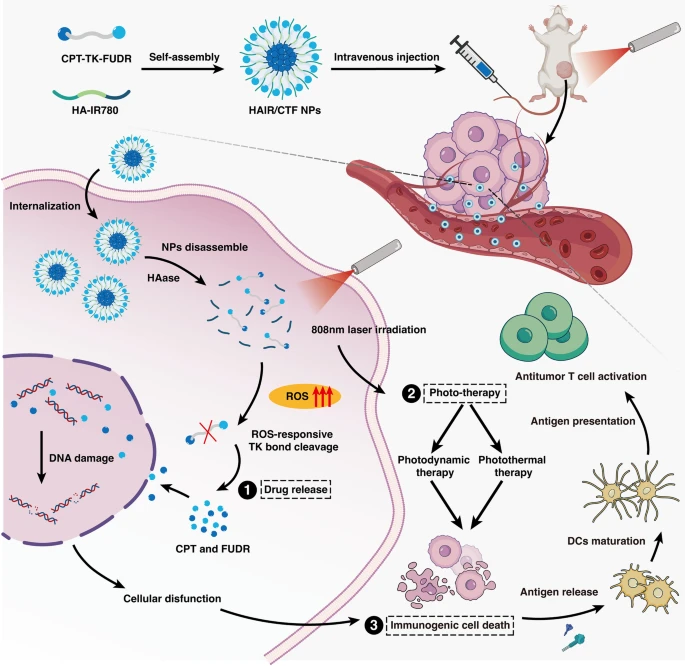
图2. HAIR/CTF NPs的制备及其抗肿瘤机制示意图
更为重要的是,HAIR/CTF纳米炸弹在特定光照下,不仅能够通过化疗药物释放实现肿瘤细胞的直接杀伤,还能通过光动力治疗(PDT)和光热治疗(PTT)协同作用进一步强化抗肿瘤效果。此外,CPT和光治疗的联合效应能够诱导免疫原性细胞死亡(ICD),从而激发抗肿瘤免疫反应,达到对原发性肿瘤和转移性肿瘤的双重抑制作用。这一创新的“HAIR/CTF纳米炸弹”展现了其在肿瘤治疗中的巨大潜力,通过精确调控药物释放时空和多种治疗机制的协同作用,成功实现了肿瘤细胞的有效清除,并展现出优异的抗转移效果。研究成果为传统化疗药物的再开发提供了新的思路,并为未来三阴性乳腺癌的临床治疗开辟了崭新的方向。该研究成果分别以“Light-Responsive conjugated polymer nanoparticles with Spatial-Controlled camptothecin release via π - π stacking for improved Combinatorial therapy of breast cancer”和“Spatiotemporal-controllable ROS-responsive camptothecin nano-bomb for chemo/photo/ immunotherapy in triple-negative breast cancer”为题成功发表于材料领域的权威期刊Materials & Design以及纳米医学领域的权威期刊Journal of Nanobiotechnology上。
以上成果由三个团队的成员合作完成。中南大学湘雅药学院陈传品教授、中南大学湘雅二医院药学部吴军勇副研究员和湖南省药品检验检测研究院王蓉蓉教授为共同通讯作者;湘雅二医院药学部博士研究生徐文杰、湘雅药学院博士研究生曾昭魁和硕士研究生田晶晶为共同第一作者。上述工作得到了国家自然科学基金等项目的资助。
(作者:曾昭魁,一审:陈传品;二审:刘文芳;三审:曹东升)
