2024年12月,中南大学湘雅药学院周文虎教授团队与中南大学湘雅三医院容鹏飞教授团队,中南大学化学化工学院侯红帅教授团队在Chemical Engineering Journal(中科院1区Top期刊,IF=13.3)杂志上以Research Article形式联合发表题为“Bismuth/Manganese-Doped Carbon Dots in Calcium Phosphate Matrix: Dynamic Conformational Nanoparticles Enhancing Tumor Accumulation, Deep Penetration, and Radiosensitivity”的原创研究论文。周文虎教授、容鹏飞教授和侯红帅教授为论文共同通讯作者,博士研究生刘佳豪、李庆年和中南大学硕士毕业研究生屠焓钰(现为香港科技大学博士研究生)为论文第一作者,中南大学湘雅药学院为第一单位和通讯单位。

放射治疗是恶性肿瘤治疗的重要手段,但其疗效常受到肿瘤放射耐受性和微环境低氧等多重因素的限制。为了克服这些挑战,该团队创新性的推出了一种新型多功能放疗增敏剂——CDBi,Mn-FA@CaP,旨在提升放射治疗的靶向性与有效性,并克服传统治疗方法中的局限性。
本研究中,CDBi,Mn-FA@CaP具有显著的放射增敏效果及类过氧化氢酶活性,CDBi,Mn-FA可在肿瘤微环境中催化生成氧气,从而有效缓解肿瘤低氧问题。同时,叶酸修饰使其具备了良好的肿瘤细胞靶向性。这些碳量子点被精确包裹在磷酸钙外壳中,形成CDBi,Mn-FA@CaP复合物,通过增强的渗透性和滞留效应(EPR效应)在体内实现了持续的肿瘤积累与优化的药物释放。
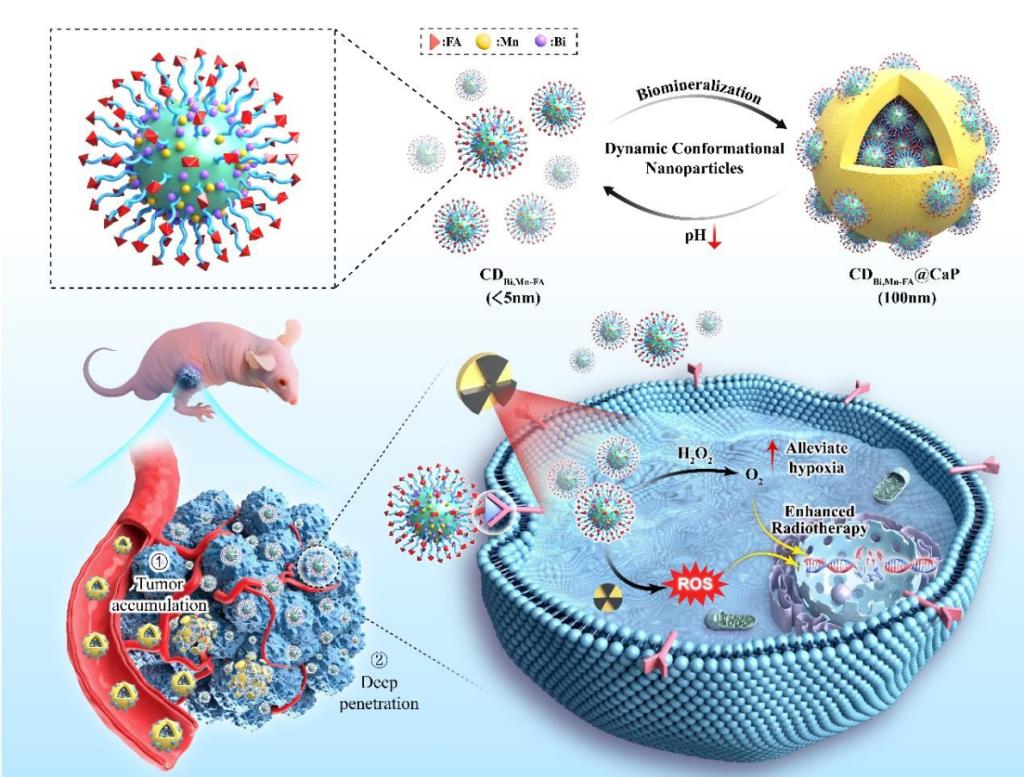
示意图:响应pH变化下的动态可变尺寸能力,以及其在体内肿瘤积累、深度渗透和增强放射治疗的机制
在酸性肿瘤微环境中,CDBi,Mn-FA@CaP复合物通过环境响应性降解,释放出更小尺寸的CDBi,Mn-FA碳点,这些小尺寸碳点(<10 nm)能够深入渗透肿瘤组织,提升放射治疗的靶向性和治疗效果。体外与体内实验结果表明,CDBi,Mn-FA@CaP纳米粒子不仅能够高效靶向肿瘤细胞,还显著增强放射治疗引起的细胞毒作用,抑制肿瘤生长。在治疗后16天,CDBi,Mn-FA@CaP联合放疗实现了40%的肿瘤治愈率;在45天,CDBi,Mn-FA@CaP联合放疗组的实验小鼠达到了100%的生存率。此外,生物相容性研究表明,CDBi,Mn-FA@CaP对全身的副作用极低,能够有效通过肾脏和粪便排除,显示出极佳的生物安全性和临床转化潜力。
本研究提出了一种创新的放射治疗增敏策略,通过设计可调节尺寸的纳米粒子系统,展现了其作为肿瘤靶向药物递送平台的巨大潜力。此研究为肿瘤治疗领域开辟了新的方向,尤其在提高放射治疗效果和实现精准治疗方面具有广泛的应用前景。
该研究还得到了国家自然科学基金、湖南省重点研发计划、湖南省教育厅科研基金以及中南大学创新驱动项目的支持。
全文链接: https://doi.org/10.1016/j.cej.2024.158683
一审周文虎,二审陈传品,三审曹东升
